







供稿人:高靖远、贺健康 供稿单位:西安交通大学精密微纳制造技术全国重点实验室 发布日期:2025-12-19
心血管系统依靠心肌的收缩功能来维持持续的血液循环,从而将氧气和营养物质输送到组织。这一关键功能取决于左心室中心肌细胞的高度单轴排列,这确保了有效的电信号传播和同步收缩。人们探索了多种策略来重现天然心肌细胞的单轴排列和相互连接的组织结构。采用静电纺丝、微加工和3D打印等技术制造的具有微纳拓扑结构的支架,能够提供单轴线索,使心肌细胞沿预设方向排列。然而,这些系统通常仅限于二维平面排列,无法重现心肌细胞正常功能所需的动态和三维细胞外基质(ECM)微环境。
西安交通大学Mao Mao等人开发了一种 InterPore 微纤维晶格,这是一种新型各向异性的电流体动力打印支架,具有纵向互连的孔,可满足ECM微环境中电信号传播的高密度心肌细胞对准和结构连接的双重要求。微纤维晶格的各向异性结构引导细胞的收缩力,导致纤维蛋白水凝胶重塑为密集的组织结构,其几何设计允许高密度细胞接种和创建具有高活力的对齐束。该系统可从新生大鼠心肌细胞中生成了心脏组织,实现了具有增强电生理特性的高度互连的细胞束。这一进展凸显了在功能性心脏修复、药物研发和组织工程方面的应用潜力,尤其是在满足高密度排列和电信号连接的关键需求方面。
图1 展示了采用电流体动力(EHD)打印技术制造了 InterPore 微纤维晶格支架。这种支架设计融合了纵向和横向的微纤维壁,并采用了一种新型的富含空隙的架构,有助于形成排列整齐、连续且密集的细胞束。InterPore 微纤维晶格由纵向和横向微纤维壁相交形成的立方体单元组成。横向纤维以每组三层微纤维的形式排列,呈现出错开的“V 形”结构。这种错开的几何形状不仅增强了孔隙间的连通性,还通过在纵向轴上形成连接相邻孔隙的空隙来确保机械稳定性。
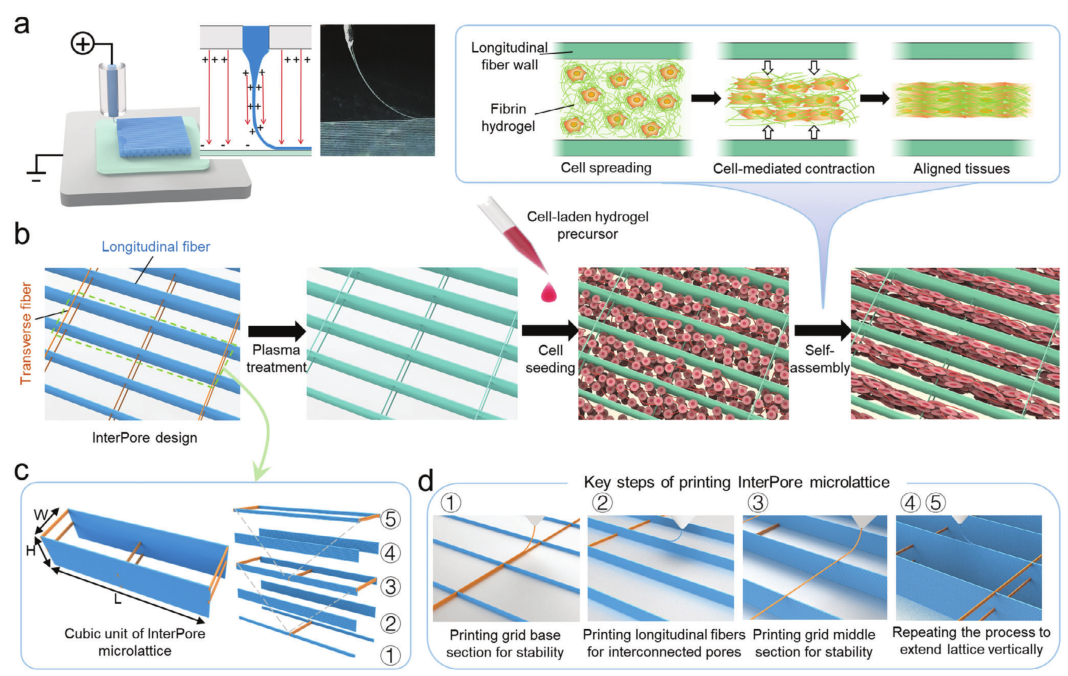
图1 使用InterPore微纤维晶格生成排列和密集的组织的示意图
为了评估 InterPore 微纤维晶格的结构优势,将其性能与传统的矩形网状微纤维晶格作为对照进行了比较。新生大鼠心肌细胞被接种到纤维蛋白水凝胶中,并在 InterPore 和对照微纤维晶格中培养,以评估晶格结构如何影响心脏组织的成熟和功能。培养5天后,InterPore 和对照微纤维晶格中的心肌细胞 自组装成高度对齐、密集的心脏组织束。然而,收缩功能和电耦合的特异性蛋白的免疫染色分别揭示了两种设计之间的显着差异。与对照组相比,InterPore 微纤维晶格内的心脏组织表现出更长、界限分明的肌节和更高的特异性蛋白表达,表明结构组织更先进,同步收缩的潜力增强。为了评估功能成熟度,测量了钙瞬变,这反映了协调心脏活动所必需的兴奋-收缩耦合。在5秒的成像周期内,对照微纤维晶格中的钙信号杂乱无章,在不同束中观察到不协调和不规则的瞬变,这表明电耦合有限和组织功能受损。相比之下,InterPore 微纤维晶格中的心脏组织显示出通过排列束传播的强烈、同步的钙波,表明电连接性得到改善。
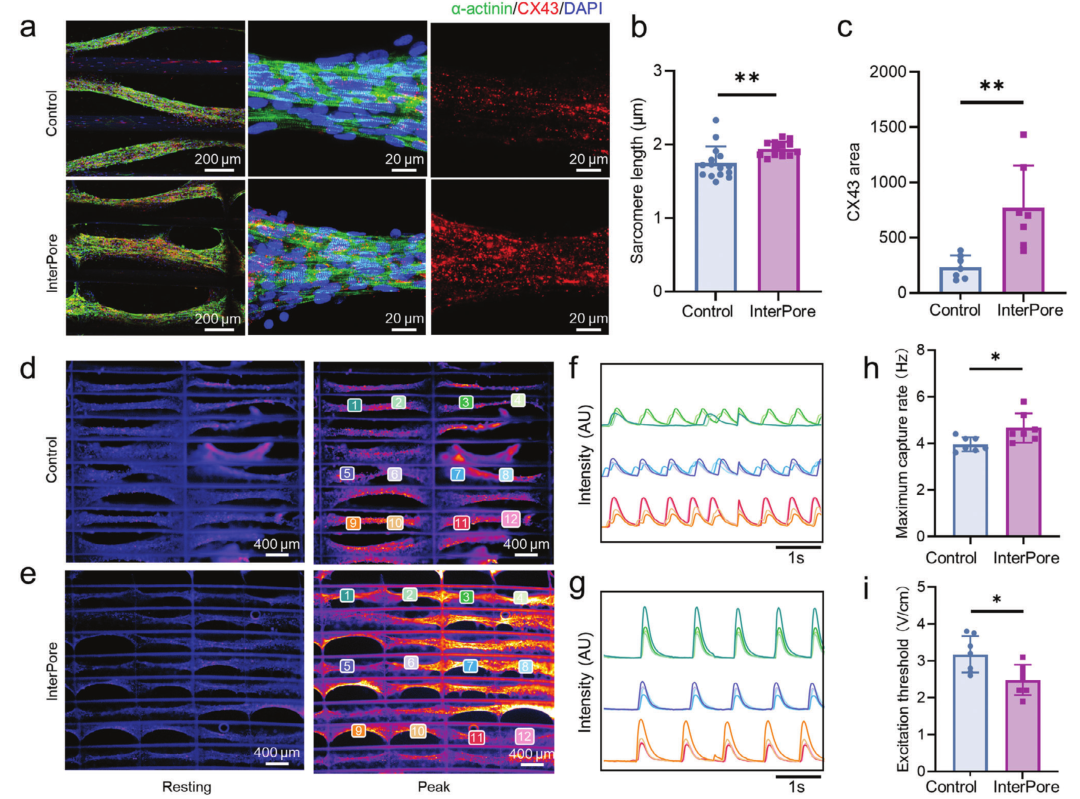
图2 工程排列心脏组织的结构表征和电生理功能
本文展示了一种通过EHD打印技术开发的各向异性微纤维晶格,通过将精确的结构控制与仿生纤维蛋白水凝胶重塑相结合,实现了高度对齐、密集的心肌束,并增强了电生理学和机械性能。这种方法在推进疾病建模、药物筛选和再生疗法的应用方面具有巨大潜力,特别是在解决高密度细胞排列、同步收缩和长期组织活力的关键需求等方面。