







供稿人:徐辰雨、贺健康 供稿单位:西安交通大学精密微纳制造技术全国重点实验室 发布日期:2024-12-21
打印充满仿生血管网络的人体组织和器官正逐渐引起研究人员的兴趣。如果不能嵌入可立即定位和可灌注的脉管系统,工程人体组织就不能在提供治疗效果所需的时间内保持活力。挤出式、嵌入式和光基生物打印的最新研究已经开始满足这一关键需求。然而,目前还没有一种方法对分层分支血管网络进行建模。因此,制造充满仿生血管网络的器官特异性人体组织仍然是一个艰巨的挑战。
哈佛大学Paul P.stankey等人开发一种可以同轴牺牲打印功能组织(co-SWIFT)的嵌入式生物打印方法,能够在颗粒状水凝胶和密集细胞基质中生成分层分支、多层血管网络。通过此方法打印出的心脏组织在灌注下成熟,同步跳动,并表现出对心脏有效的药物反应。这一进展为药物测试、疾病建模和治疗用途的血管化器官特异性组织的可扩展生物制造开辟了新的途径。
图 1 展示了功能组织中的同轴牺牲打印工艺原理。研究人员设计了一种新型的同轴打印头。该打印头由一个扩展的芯-壳喷嘴组成,具有两个独立可控的流体通道,用于芯和壳油墨。使用优化的芯-壳墨水组合,由围绕可灌注管腔的平滑肌细胞负载壳组成的仿生血管被同轴打印到由透明藻酸盐微粒、牺牲微粒负载胶原蛋白或源自人类诱导多能干细胞的心脏球体的颗粒基质中。
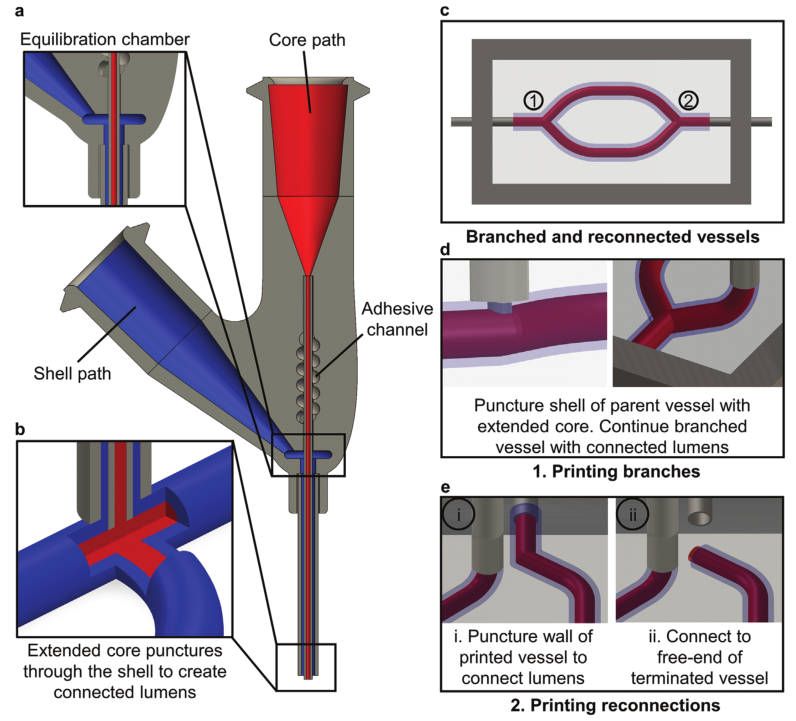
图1 同轴牺牲打印工艺原理
由此方法打印出的仿生血管网络由 SMC 负载壳墨水围绕牺牲明胶核心墨水组成,该墨水位于 μPOROS 基质内,并在打印期间保持在其凝胶温度以下。打印后加热至 37°C 后,壳墨水和 μPOROS 基质中的胶原蛋白凝胶化和交联,同时熔化牺牲明胶核心。SMC 负载壳墨水凝胶化形成血管壁,血管壁环绕着去除核心墨水后形成的互连管腔网络,并将内皮细胞接种到嵌入血管的管腔表面上。培养后,平滑肌细胞包围的汇合内皮细胞层组成血管。
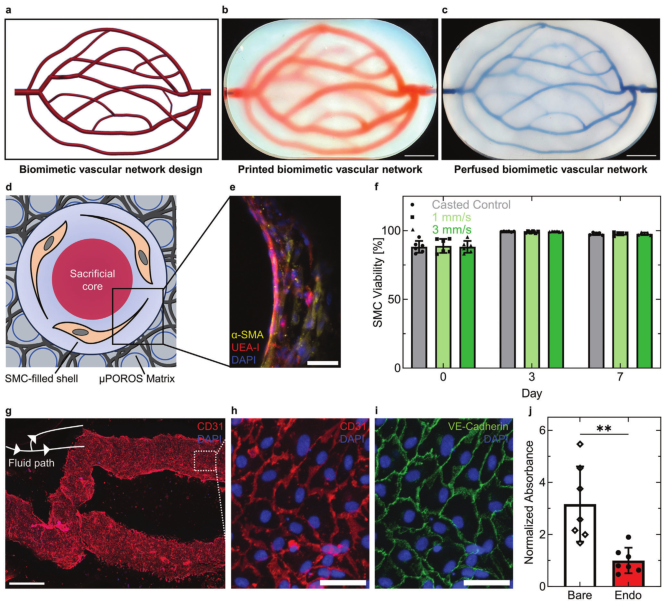
图2 仿生血管的内皮化
本文展示了一种基于同轴的生物打印方法,能够将分支多层血管网络嵌入无细胞和密集细胞组织基质中。通过设计、制造和实施定制的扩展核心-外壳喷嘴,打印由围绕牺牲核心墨水的载有平滑肌细胞的外壳墨水组成的分层分支血管。这种网络具有相互连接的管腔,管腔被平滑肌细胞包裹并接种内皮细胞以形成具有良好屏障功能的融合内皮,为在软组织和活组织结构中嵌入仿生血管网络提供了有利的进展。