







供稿人:刘岩、李骁 供稿单位:西安交通大学精密微纳制造技术全国重点实验室 发布日期:2024-12-15
源自人类诱导性多能干细胞的工程化心脏组织 (ECT) 是心脏修复、患者特定疾病建模和药物发现的可行替代方案。然而,ECTs的未成熟状态限制了它们的临床应用。因此,为了整合组织的三维特性以及心肌的特征形态,使用具有与天然心肌相似的三维高度有序微结构和特征尺寸的支架可能是促进 ECTs成熟的潜在方法。基于电流体动力学 (EHD) 的3D打印方法,被认为是创建具有明确体系结构的高度复杂和多组分结构的有效选择。由于传统 EHD打印的固有机制,实现具有细胞特征尺寸的3D高度有序微结构仍然是一个重大挑战。
青岛理工大学Zhang Guangming等人报告了一种制造可促进ECTs成熟的微结构的策略,利用电场驱动(EFD)打印了具有细胞特征尺寸的3D高度有序微结构,以促进ECTs的成熟。这些微结构在心脏组织工程中的潜在应用表明3D打印支架在生物医学领域的潜在适用性及其促进心肌细胞成熟的能力。
图 1 显示通过EFD喷射微尺度3D打印,对具有单元特征尺寸的聚乳酸的3D高度有序微观结构的制造过程。与传统的带有两个电极的EHD喷射打印不同,EFD打印系统取消了接地电极。因此,EFD射流微尺度印刷中驱动电场的产生方法主要是基于喷嘴尖端与基板/印刷结构顶表面之间的电荷极化。制造过程分为三个步骤: 第一步是在精确沉积的情况下打印具有临界纤维间距的单层网格结构。EFD打印克服了射流斥力,使导电基材和绝缘基材上都发生了射流吸引;第二步是进一步减小印刷网格的纤维间距。采用对称路径方案在先前打印的两根相邻纤维的中间进行打印,平衡了静电力对射流的影响,从而使射流垂直向下定向到基材上,并按照预定路径精确沉积;第三步是3D打印多层微结构。

图1 EFD打印原理
将hiPSC-CMs在三维高有序结构(纤维直径为20 μm,纤维间距为80 μm)的支架中培养,形成定向ECTs结构,心肌细胞沿聚乳酸纤维呈高度排列和排列的微结构。免疫细胞化学染色显示3D打印支架促进了ECTs的定向,其长轴沿肌原纤维规律排列。此外,支架中发育的ECTs具有同步功能,其特征是钙成像具有同步传输、协调频率和相似振幅,并证明ECTs中钙处理效率高的参数。结果表明,在这样的纤维直径和较小的纤维间距下,3D打印高度有序的微观结构促进了ECTs的成熟。
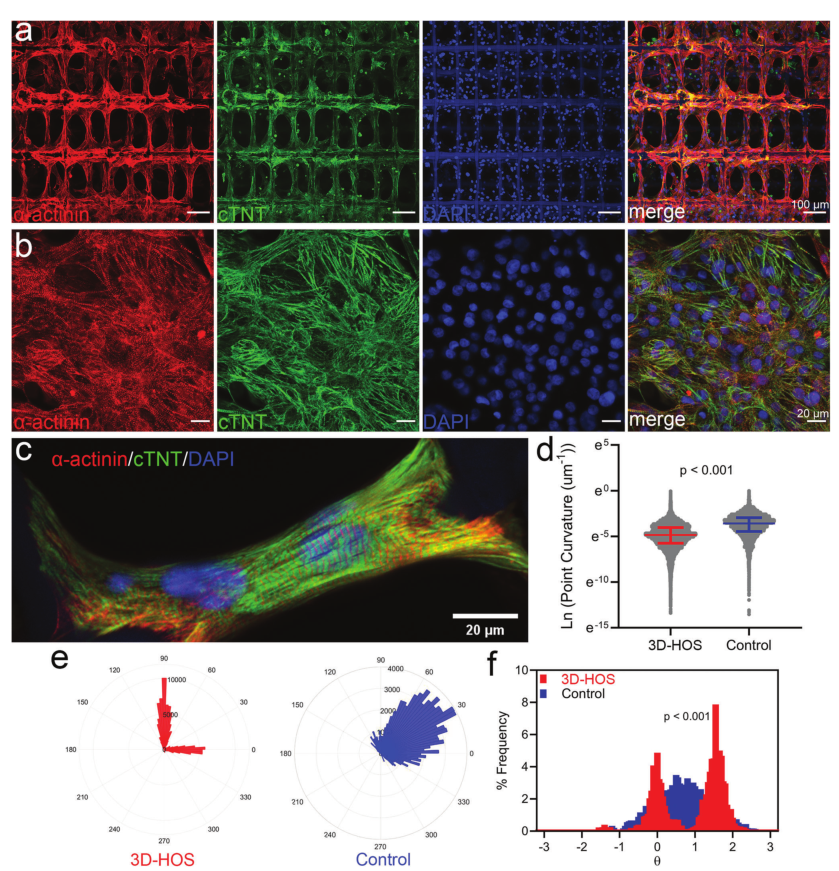
图2 3D打印支架引导hiPSC-CMs对齐以开发定向的ECTs
本文展示了一种新的基于电场驱动的打印策略,制备出纤维直径为10-20μm、纤维间距为60-80μm的三维高度有序微结构,纤维直径/间距比最大可达0.29。EFD微尺度打印工艺有利于支架的制备,为促进ECTs成熟提供了合适的微环境,在心脏组织工程中具有一定潜力。