







供稿人:张晨蕊、王玲、李涤尘 供稿单位:西安交通大学机械制造系统工程国家重点实验室 发布日期:2024-05-08
核壳结构抑制细菌生长及瘢痕产生的主要过程与机理如图1所示,PVA壳内包裹VP药物,在激光照射下可促进ROS的产生,破坏细菌膜,随着时间推移,PVA降解,释放维替泊芬通过阻断成纤维细胞中Engrailed-1(En1)的激活来抑制瘢痕的形成。

图1 由核壳结构组成的PF-MNs无瘢痕伤口愈合示意图
研究了不同PVA和TSPBA比值的壳层中VP的释放谱,并考虑到其适当的降解时间(24h),确定了2:1的比例。此外,PF-MNs中VP的释放速率也可以通过过氧化氢的浓度来调节VP可以通过抑制相关蛋白(YAP)来阻断En1的激活,通过较少的平滑肌肌动蛋白(α-SMA)产生皮肤再生,α-SMA是活化肌成纤维细胞的标志,利于瘢痕形成。
体外抗菌性能:基于菌落计数评价了PF-MNs的抗菌性能,设置了有激光照射组(PF-MNs+L)与无激光照射组(PF-MNs),证实了激光照射对材料抑菌的重要作用,抑菌率可达72.39%。
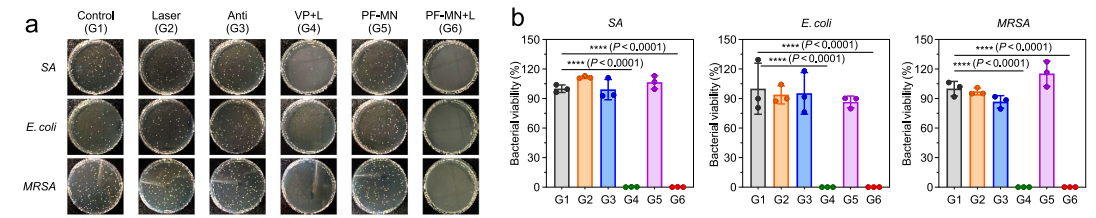
图2 细菌分布情况
本文还研究了PF-MNs对糖尿病创面慢性炎症的影响,将小鼠随机分为6组:(1)对照组(PBS)、(2)抗组(氨苄西林)、(3) VP + L组(激光照射VP溶液)、(4) NMNs + L组(VP加载不可降解MNs激光照射)、(5) PF-MNs组(VP加载PF-MNs)、(6) PFMNs + L组(VP加载PF-MNs)。分别于第0、3、7、14天测量不同组的创面面积并拍照,结果如图3所示。PF-MNs处理后的材料光照后对伤口愈合更友好,从定量的角度来看,PF-MN + L组在治疗后第3天和第7天创面闭合率分别为36.58%和76.46%,显著高于PBS处理的创面(分别为4.89%和56.95%)。第3天,通过收集创面周围的皮肤组织并均质化,评价其抗菌膜的性能(图4d,e)。PF-MNs激光照射处理的创面菌落数最低,细菌存活率为18.60%,表明其对细菌生物膜有有效的抑制作用。综上所述,研究结果证实了PF-MNs通过抑制促炎途径和促进皮肤重建途径来加速慢性伤口愈合。
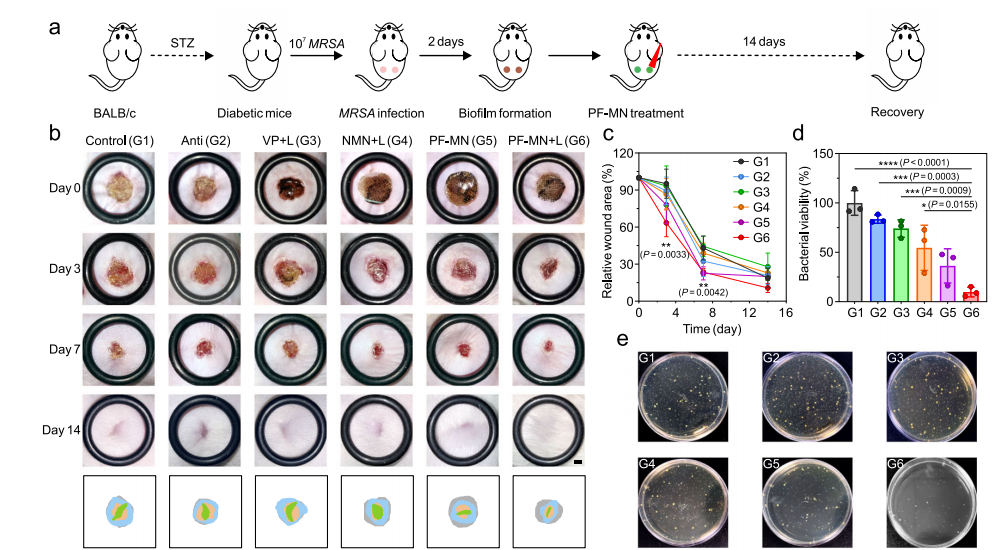
图3 MRSA感染糖尿病小鼠体内创面愈合效果
本文进一步进行了转录组学分析,以研究PF-MNs加速伤口愈合的潜在机制,结果显示,各组间(PF-MN + L与NMN + L和对照)的基因表达存在显著差异,PF-MN + L组中与表皮发育和皮肤发育相关的基因上调,而与炎症通路相关的基因下调,如细胞运动信号、白细胞趋化、IL-6的产生和炎症反应的调节,利用KEGG分析了潜在信号通路上的信号,TNF和核苷酸结合寡聚化结构域(NOD)样受体信号通路表达下调,这被认为是M1激活相关通路。综上所述,研究结果证实了PF-MNs通过抑制促炎途径和促进皮肤重建途径来加速慢性伤口愈合。
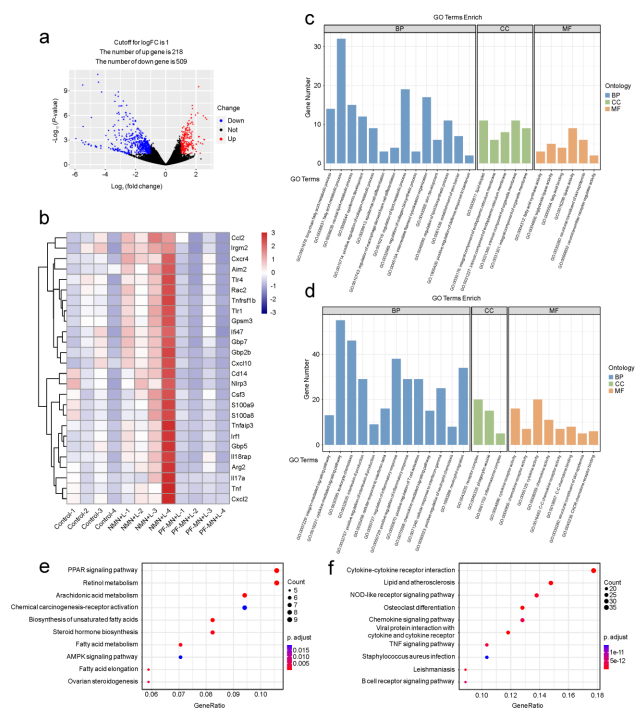
图4 PF-MN 治疗伤口愈合的机理分析
分别对PF-MNs对瘢痕抑制及瘢痕增生抑制进行了评价,发现游离的VP组与PF-MNs组瘢痕变软变薄,这说明VP的存在可有效降低瘢痕的产生,利于伤口的恢复,另外,对恢复的样本(35天后)进行切片染色分析发现,PF-MNs组一直瘢痕增生效果最佳。
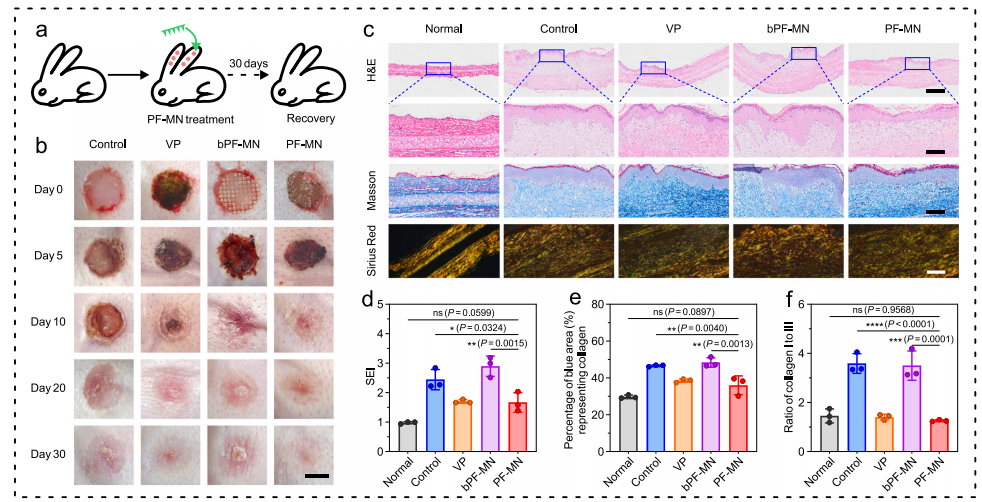
图5 PF-MNs 抑制瘢痕及瘢痕增生
本文开发了一种核壳结构的PF-MN贴片,以编程的方式推进伤口愈合过程。在炎症早期,PF-MNs在激光照射下产生ROS产生杀菌作用。随后,VP@PVA壳在高度氧化的伤口环境下响应性降解,释放VP,促进无疤痕皮肤再生。同时,暴露的核心通过中和过度的炎症细胞因子和诱导巨噬细胞极化来调节免疫微环境。我们的研究结果表明,这种核壳结构的贴片可以促进MRSA感染的糖尿病小鼠的慢性伤口愈合,也可以减轻兔耳瘢痕模型中的HS。为了潜在的人类用途,PF-MNs可以很容易的适应伤口的大小,并应用于伤口区域。