







供稿人:张晨蕊、王玲、李涤尘 供稿单位:西安交通大学机械制造系统工程国家重点实验室 发布日期:2024-01-04
提出了新型的多组分微球(MCMs),具有共封装和时空药物释放能力,用于肝癌术后的治疗和肝再生。MCMs通过逐步微流控平台制备,由海藻酸钠(ALG)壳和甲基丙烯酸明胶(GelMA)芯组成。得益于“颗粒中颗粒”结构,mcm提供了分别将阿奇霉素(DOX)和肝再生增强剂(ALR)加载到壳和核的可能性。此外,MCMs使DOX快速释放,ALR更持续释放。因此,双载药MCMs具有显著的术后杀伤肿瘤和促进肝再生的作用。
图1介绍了多层载药凝胶微球的制造过程,GelMA微球首先通过液滴微流控技术生成,并悬浮在海藻酸钠溶液中。然后将溶液进行电喷雾,通过氯化钙诱导的交联生成ALG微粒,并将GelMA微球嵌入在中。抗肿瘤药物DOX和肝再生增强剂(ALR)分别加入ALG和GelMA。由于“粒子中粒子”结构,MCMs使DOX的初始快速释放和随后的ALR连续释放。
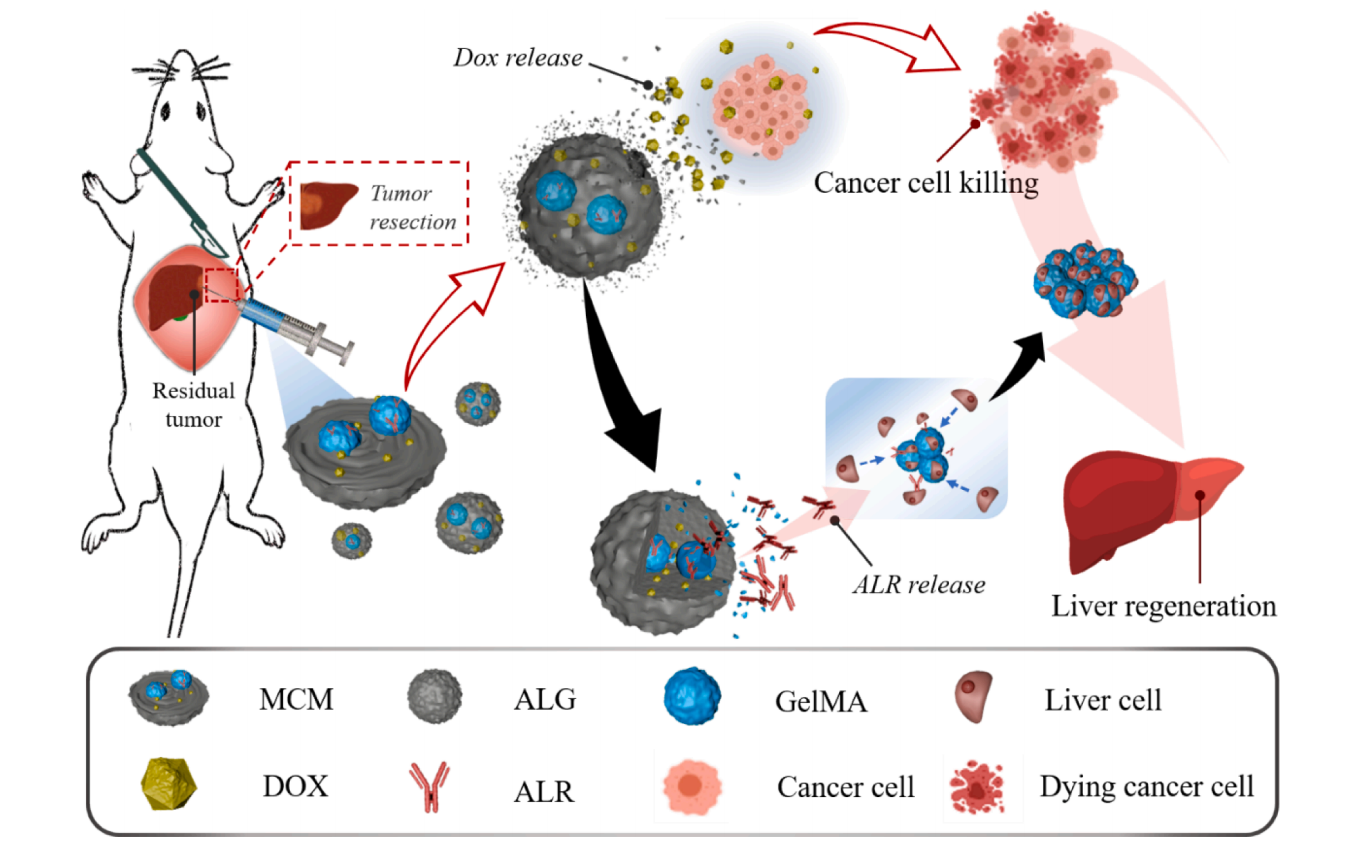
图1 由DOX负载ALG壳和ALR负载GelMA核组成的多组分微球示意图
图2介绍了MCMs的制造示意图,并对制造出的水凝胶微球的尺寸及大小进行了表征。首先MCMs是通过双步微流控工艺制备的,制备了一个用玻璃毛细管构建的微流控装置来生成GelMA微球。该装置由两个玻璃毛细管组成,锥形尖端从相反的方向插入一个较大的方形毛细管。在该装置中制备了油中水(W/O)单个乳化液滴。内相流体为流过注射管的GelMA预凝胶溶液(10 wt%),外相流体为蓖麻油,流过注射管与方形毛细管之间的空隙。用一个装满相同油溶液的容器来收集液滴。然后,将得到的液滴暴露在紫外(UV)光下,通过光聚合生成GelMA微球。然后,将GelMA微球与海藻酸钠溶液(1 wt%)混合,并进行电喷雾,这种海藻酸盐溶液是通过一个由单一的锥形圆柱形毛细管组成的电喷雾微流控装置注入的,在典型电压为6 kV的电场下形成液滴。内部含有GelMA微球的ALG微滴落入一个装满氯化钙溶液的容器中。ALG和Ca2+之间的快速离子交联导致了固体ALG微粒的形成,GelMA微球嵌入在内部,即MCMs。所制备的mcm具有独特的颗粒间结构。此外,通过调节微流控电喷雾参数,可以控制嵌入的GelMA微球的数量。通过改变GLG溶液中GelMA微球的体积比、电压和流量,可以调节捕获的GelMA微球的数量。随着GelMA微球在ALG溶液中的体积比的增加,ALG液滴中含有更多的GelMA微球,因此最终的MCMs能够封装更多的GelMA岩芯。此外,随着流量的增加或电压的降低,液滴的体积增加,从而使更多的GelMA岩芯可以封装在MCMs中。
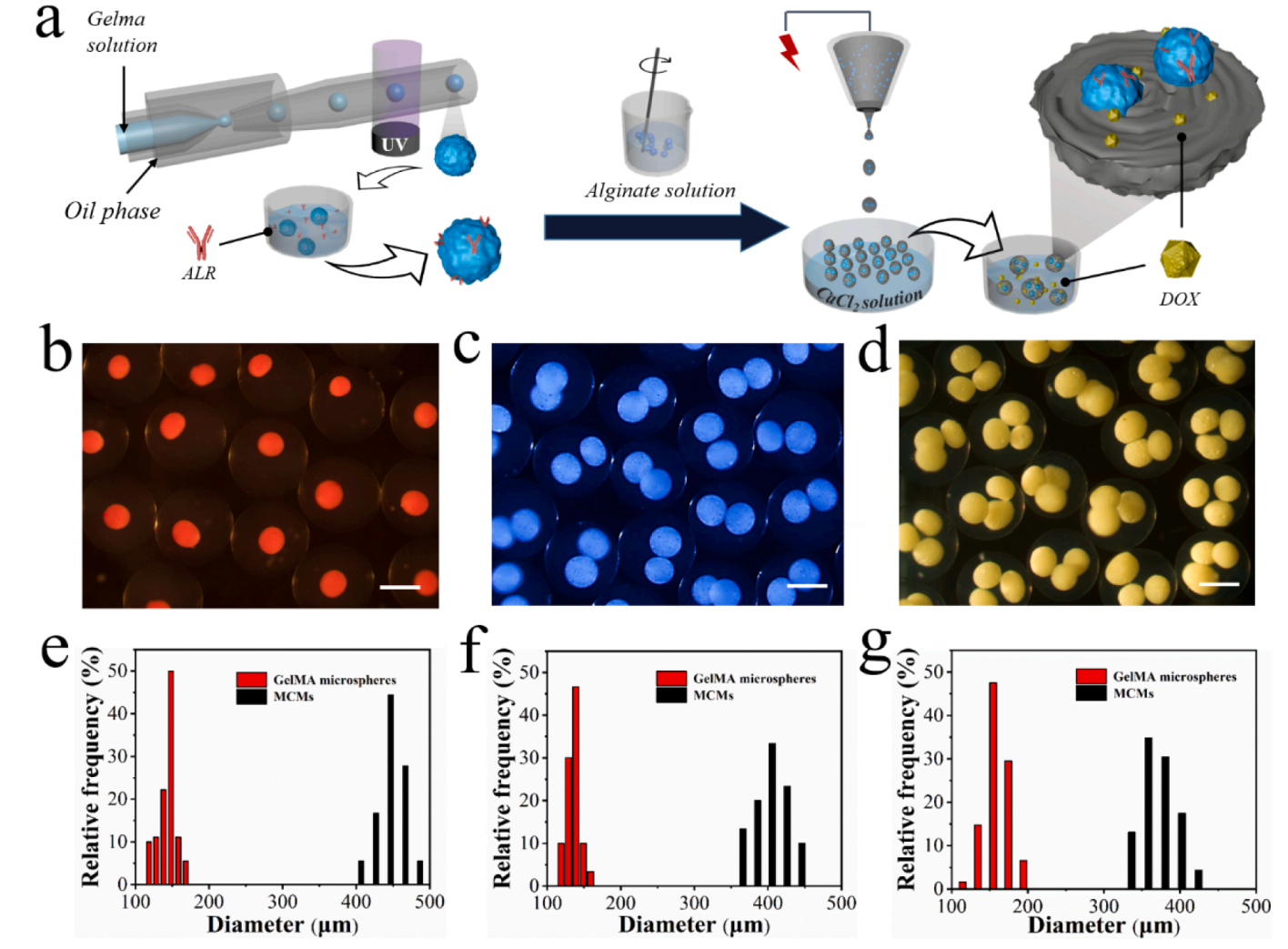
图2 (a)MCMs生成过程示意图;(b-d)分别嵌入(b)单、(c)双和(d)三重GelMA微球的MCMs的光学显微图像
所制备的MCMs具有独特的颗粒间结构。为了证实这一点,作者分别将DOX和BSA-FITC分别装入ALG和GelMA微球中,在荧光显微镜下显示出红色和绿色荧光。通过荧光强度,以判断药物释放的时间及随时间变化药物释放规律。
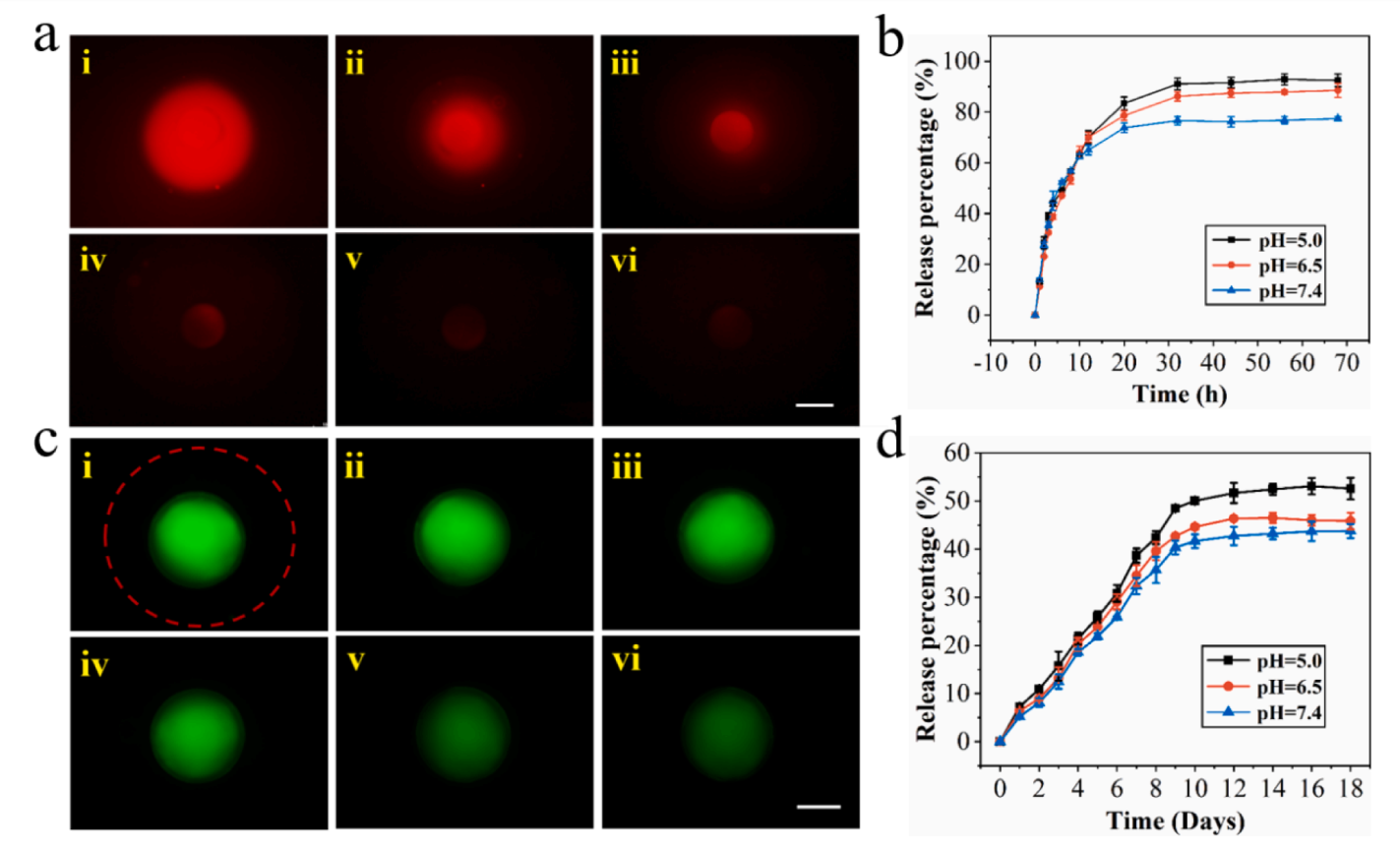
图3 DOX和BSA-FITC的体外释放谱。(a)荧光图像显示(i) 0 h、(ii)1 h、(iii)2 h、(iv)3h、(v) 5 h、(i)7h后加载DOX的MCMs;不同pH值的PBS累积释放曲线;(c)荧光图像显示加载BSA-FITC的GelMA微球(i) 0 h、(ii)12 h、(iii)、1d、(iv)2 d、(v)4d后的MCM;不同pH值的MCMs的BSA-FITC的(d)累积释放曲线
为了研究MCMs在术后治疗中体内抗肿瘤的作用,构建了小鼠H22原位肝癌模型。两周后,我们切除90 %的肿瘤,切除部分邻近肝组织,建立不完全肿瘤切除模型(图4a)。此外,为了保证术后肿瘤体积的相对同质性,将小鼠随机分为对照、ALG、DOX、DOX-ALG和DOX/ALR MCMs组,如图4所示,各组间切除肿瘤的重量和体积无明显差异。记录每组小鼠肿瘤体积,分析不同治疗的结果。值得注意的是,DOX的治疗明显抑制了复发的肝肿瘤。其中DOX-ALG和DOX/ALR-MCMs组残瘤体积明显小于游离DOX组,两者间无统计学性差异,如图4b、4c所示。然后,对反映肿瘤增殖情况的Ki67和增殖细胞核抗原(PCNA)进行免疫组化(IHC)染色,评价肿瘤细胞的增殖情况。如图4d所示,DOX-ALG组和DOX/ALR-MCMs组肿瘤细胞Ki67和PCNA的表达明显较低,说明肿瘤细胞增殖受到抑制。此外, HE结果显示,治疗后各组小鼠的主要器官均无明显损伤。这些结果表明,载药MCMs为术后肿瘤复发提供了一个实用的解决方法。
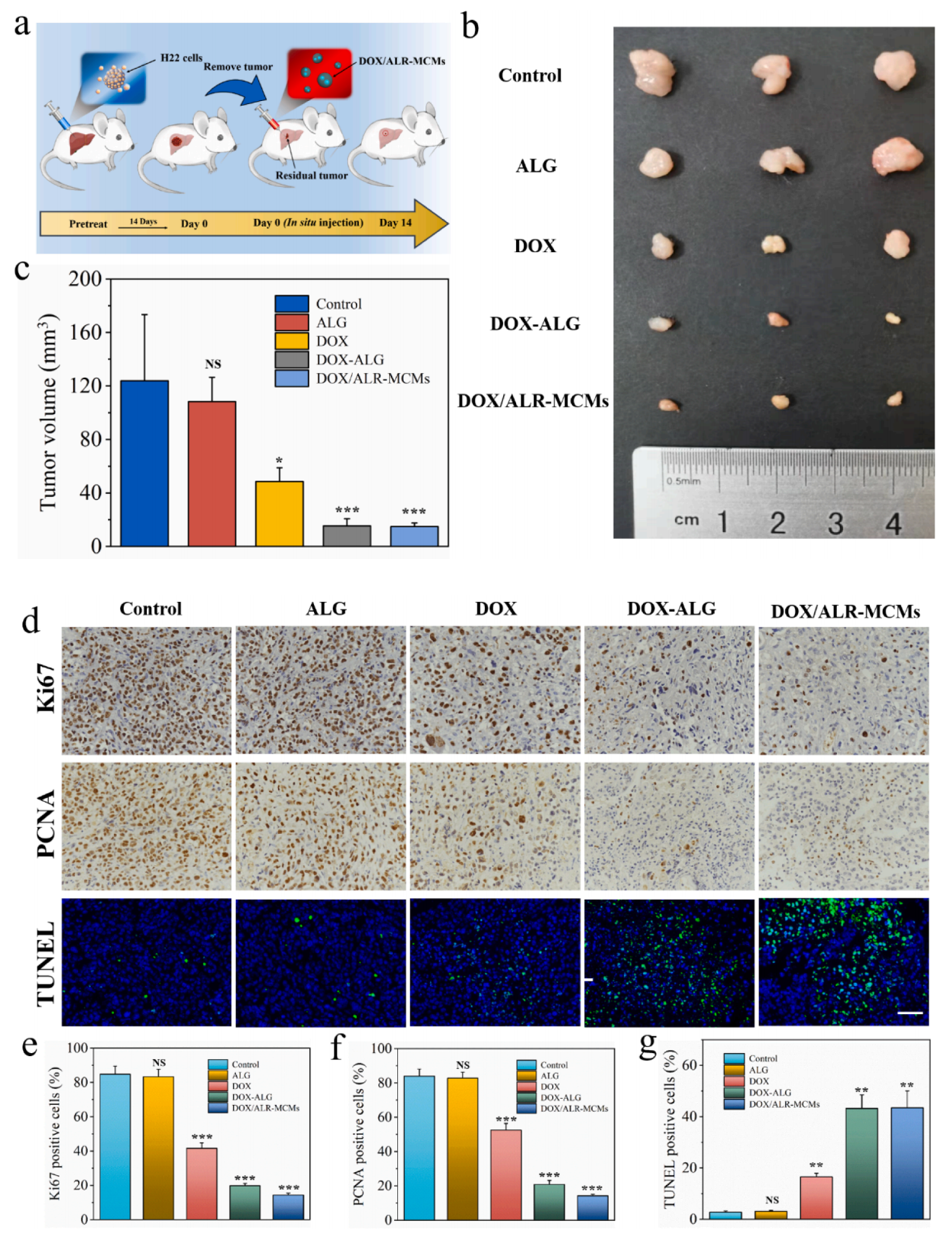
图4 (a)小鼠原位H22肝癌模型构建及肿瘤切除后MCMs治疗示意图;(b)术后给药后14天3组平行实验小鼠残留肿瘤组织体积;(c) TUNEL凋亡试验统计;(d)免疫荧光图像和Ki67、PCNA免疫染色图像评价;(e-g)Ki67、PCNA、TUNEL阳性染色的肿瘤细胞定量统计。(比例尺为50 μm。* p < 0.05, ** p < 0.01, ***p < 0.001)
一般来说,术后化疗可能存在增加肝损伤和导致肝功能衰竭的风险。为了克服这一困境,我们将MCMs设计为同时加载DOX和ALR,从而在抗肿瘤治疗和促进肝再生中发挥双重作用。为了确认ALR负载MCMs切除后对小鼠的肝再生能力,我们将小鼠分为对照组、GelMA、A-ALR、ALR-GelMA和DOX/ALR-MCMs组,结果发现,装载ALR的GelMA微球和DOX/ALR的MCMs处理小鼠血清反映肝损伤的ALT和AST水平显著降低(图5b,5c),对肝损伤有修复作用。此外,IHC结果显示,在ALR-GelMA组和DOX/ALR-MCMs组中,PCNA和Ki67的表达增加(图5a)。这些结果表明,DOX/alr负载的MCMs对肝损伤有保护作用。

图5 (a)Ki67和PCNA免疫染色图像,用于分析各组肝细胞增殖活性;(b,c)Ki67和PCNA染色阳性的肝细胞定量分析结果;(d,e)部分肝切除后48 h不同治疗小鼠血清;(d) ALT和AST水平。(比例尺为50 μm。* p < 0.05, ** p < 0.01, ***p < 0.001)
综上所述,本文开发了新型多组分微球,由DOX负载的ALG壳和ALR负载的GelMA核组成,实现肿瘤杀伤和肝再生的多功能,用于术后肿瘤治疗。这些微球表现出独特的“颗粒中颗粒”构型,以及其他优点,包括其尺寸均匀、结构稳定性和生物相容性。受益于这些优势,微球使DOX快速释放和ALR持续释放,从而支持最初的抗肿瘤治疗和持续促进肝再生。在此基础上,构建了肿瘤不完全切除合并肝部分切除的模型,证实了残余肿瘤的生长明显受到抑制,并促进了肝再生。此外,该微球具有药物的时空释放能力,可作为将两种抗肿瘤药物共封装、实现协同和梯度抗肿瘤作用的良好平台。