







供稿人:王森、王玲 供稿单位:西安交通大学机械制造系统工程国家重点实验室 发布日期:2023-05-25
在机械和功能上与原生血管组织相当的体外血管组织三维生物打印是一个尚未解决的挑战。近期,哈佛医学院的Y. Shrike Zhang和麻省理工学院的赵选贺等人基于一种强韧双网络生物墨水及其微流控同轴打印方法制备了单层和双层导管结构,分别用于重建静脉样和动脉样组织。打印的静脉和动脉导管具备各自血管的关键功能,包括力学性能、灌注性、屏障性能、特异性标记物的表达,其中动脉导管还具有生理性血管收缩和扩张反应。进一步通过Covid-19 病毒的感染性及在体血管接合导通性证明了其作为体外疾病研究的血管模型和体内血管手术移植物的潜力,相关论文发表在Science Advanced杂志上。
双网络水凝胶由明胶和海藻酸钠组成,通过钙离子物理交联海藻酸钠形成第一级网络,以微生物转谷氨酰胺酶(mTG)化学交联明胶形成第二级网络,此外海藻酸盐和明胶之间存在强静电作用(图1A)。第一级网络由致密可逆离子交联形成,大幅提升水凝胶刚度与能量耗散能力;第二级网络由酶引发的稀疏共价交联形成,赋予了水凝胶良好的弹性和柔性。相比于单组分水凝胶,该双网络水凝胶表现出了优异的机械性能(图1B-1D)。研究者分别利用定制化的双通道和三通道同轴喷头打印单层和双层中空管状结构(图1E-1F)。芯层材料为氯化钙,针对静脉打印的仿生单层导管结构的管壁材料由中粘度海藻酸盐(MAlg)及明胶组成(Bioink-1),以提供细胞黏附与形成强韧力学支撑。针对动脉打印的仿生双层导管结构的外壁材料由低粘度海藻酸盐和光固化明胶组成(Bioink-2),以支持细胞生长。打印的导管结构具有良好的可灌注性和选择渗透性能力,且与小鼠天然血管相比,其机械性能无显著差异(图1G)。
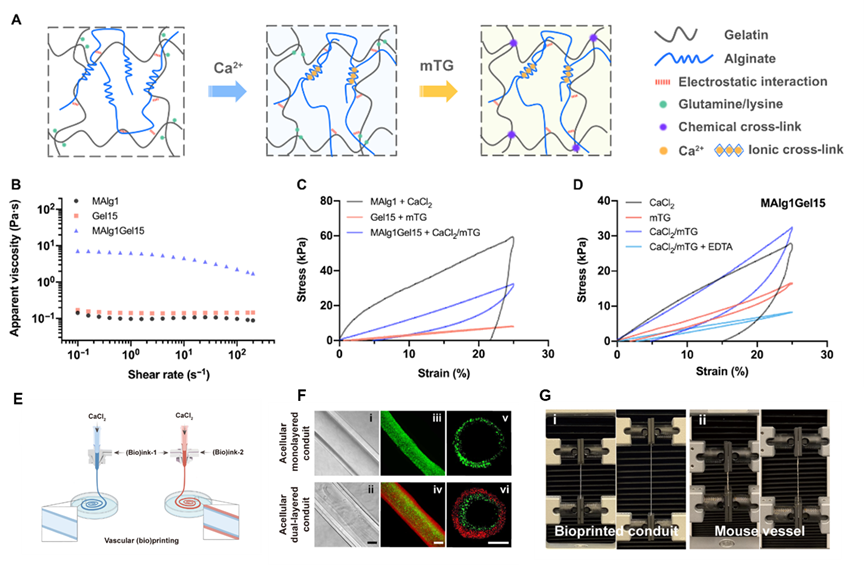
图1 强韧双网络水凝胶生物墨水性能及微流控挤出生物打印导管
针对体外模型应用,研究者通过SARS-CoV-2伪病毒(pCoV-VP)感染来研究人工血管的直接反应,并采用两种临床批准用于COVID-19的抗病毒药物瑞德西韦 (RMD) 和阿莫地喹 (ADQ) 处理感染后的血管,以观察抗病毒药物的有效性。pCoV-VP 感染前的染色表明,接种于人工血管的平滑肌细胞和内皮细胞高表达了SARS-CoV-2感染的关键受体—ACE2(图2A)。病毒处理后实验表明,人工血管容易受到SARS-CoV-2感染,并且在抗病毒药物存在的情况下,pCoV-VP 的细胞病变作用降低,细胞活性和代谢活性明显提高(图2B-2C)。针对体内实验,研究者分别进行和离体和体内吻合实验。首先,通过不同管径的人工血管分别与直径约1 mm的离体小鼠主动脉和直径约5 mm的离体人静脉通过组织胶水进行吻合,并灌注以荧光染料,观察到染料流通通畅,在吻合口处或血管壁处均未发现泄漏(图2E);其次 ,在活体小鼠中,将人工血管移植至小鼠腔静脉断端,打开血管夹后,发现血流通畅无泄漏,因此初步证明了其作为组织移植物的可能性(图2F)。

图2 生物打印血管导管的体外和体内应用
总之,该研究开发了由明胶(或GelMA)和藻酸盐组成的双网络强韧水凝胶(生物)墨水,具有合适的流变性能和生物相容性,用于工程化小直径血管导管的微流体(生物)打印。生物打印的静脉和动脉导管分别由内内皮层和外平滑肌层组成,分别模仿了原生静脉和动脉的重要特征。致密的内皮单层提供了屏障功能,动脉导管较厚的平滑肌层允许导管像原生小动脉一样收缩和扩张。生物打印的血管导管也可以作为很好的体外血管模型,用于研究血管对病毒感染的反应和抗病毒药物的疗效及在体内应用的血管移植的潜力。与该领域已有的进展相比,本研究的同轴生物打印血管导管在物理性能和生理稳定性上均具有显著优势。