







供稿人:李晨、贺健康 供稿单位:西安交通大学机械制造系统工程国家重点实验室 发布日期:2023-02-01
随着3D组织模型在生物学、医学和药学领域的兴起,人们越来越意识到传统2D细胞培养技术的局限性,因为3D组织模型可以获得更准确的结果,这主要依赖于其能创建更真实的细胞环境,因为3D组织模型中的细胞间和胞质间相互作用与体内条件更加接近,并且这些人工3D组织也可能被用作再生医学的组织替代物。然而,由于细胞基质和细胞密度的限制,创建尺寸在0.6mm-1mm之间的人工3D组织模型仍然是一个关键的挑战。并且,人工3D基质应尽可能模拟复杂的细胞相互作用,并促进细胞在3D环境中的附着、存活和增殖。
针对上述问题,维尔茨堡大学功能材料与生物制造研究所的研究人员提出了利用热敏材料的牺牲支架,将其整合在水凝胶中制造仿生微血管网络结构的制造策略。使用熔融静电打印技术打印可牺牲热敏材料支架,制造具有高精度微流道模板,使用水凝胶前体溶液在25℃以上填充,并在25℃以下与水凝胶融合形成高精度的可灌注仿生微血管网络。其制造的分叉结构平均直径在87μm-275μm之间,并且通过在流道内灌注细胞,可以在三天内快速形成紧密且具有生物功能的内皮层。
研究人员通过使用不同的显微技术对微流道内细胞的细胞核、CD31和F-actin进行染色和评估,以检测细胞形态和3D流道内的流变附着情况。结果显示细胞均匀附着在管腔表面,且细胞数量较多(图1A)。并且可以看到内皮细胞形成的内皮单层均匀充满微流道表面(图1B)。基于内皮化微流道的三维模型重建,研究人员还对分叉流道的细胞培养基进行了数值流动模拟(图1C),分析表示介质通过分支时虽然速度略有上升,但并没有显著影响壁剪应力。通过对具有不同分叉角度的微流道中的流体进行数值模拟,分析了分叉角度对三种不同微通道设计的影响(图3D)。分析表明流体速度和剪应力并不会随着分叉角度的增加而显著改变。

图 1 微流道内皮化的表征。(A)微流道管腔上CD31阳性内皮单层的3D图像。(B)具有内皮层的完整微流道的多光子成像。(C)嵌入微血管中流动的数值分析。基于(B)中内皮化样品的几何特征,在3D模型中灌注细胞培养基的流动剖面和诱导壁剪应力。(D)在具有不同分叉角度的微流道的参数化三维设计中,计算血液灌注的流动剖面和诱导壁剪切应力。
为了研究内皮层的通透性,研究者使用了两种不同尺度的异硫氰酸荧光素标记的葡聚糖,分别为20kDa和200kDa,在注射葡聚糖开始时和2小时后分别观察其在水凝胶基质中的扩散情况(图2A)。通过测量内皮化与非内皮化微流道内和周围水凝胶基质中的荧光强度,以评估内皮层提供的屏障功能。结果表明内皮层的存在大大减少了两种尺度葡聚糖向水凝胶基质中的扩散程度(图2B)。注射20kDa和200kDa葡聚糖后,与非内皮化流道相比,内皮化流道中观察到的向周围水凝胶的扩散减少了约25%和30%(图2C, D)。结果表明微流道内的内皮层足以模拟血管的屏障功能。
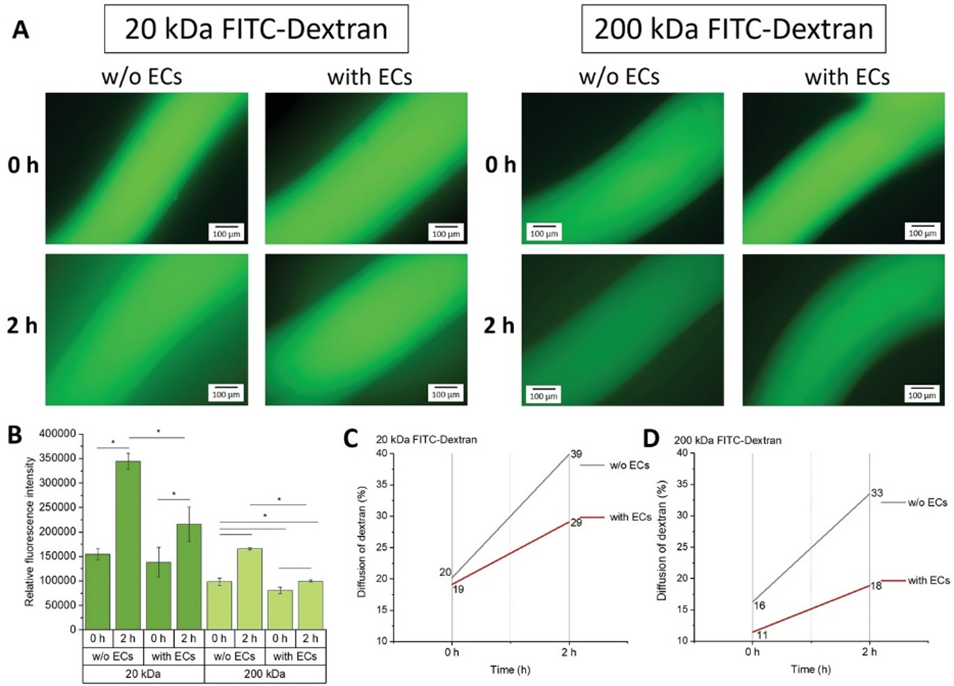
图 2 荧光标记葡聚糖检验的微流道内内皮层通透性。(A)在微流道中灌注葡聚糖后0 - 2小时的荧光图像。左:20kD葡聚糖;右:200kDa葡聚糖。(B)有无内皮层微通道间扩散速率的比较:葡聚糖分子扩散到水凝胶中的荧光强度。(C, D)两种尺度葡聚糖扩散的百分比计算。
尽管该方法成功制造了具有内皮功能的可灌注仿生微血管网络,但依然有需要改进的地方。例如,在熔融静电打印出的可牺牲支架中填充水凝胶前体溶液时,由于支架的力学性能较差,无法维持打印支架的形状,导致微流道的结构无法按照预期的设定在水凝胶中形成;当制造复杂结构的微流道时,无法保证所有流道的成型精度。在未来,可以通过改变材料的属性和其与水凝胶前体溶液的结合方式克服这些问题。通过与多材料打印相结合,制造成型精度更高,稳定性更好的人工3D组织模型。