







供稿人:王森、王玲 供稿单位:西安交通大学机械制造系统工程国家重点实验室 发布日期:2022-07-01
神经血管单元(neurovascular unit, NVU)由多种类型的脑细胞组成,多细胞共同作用,维持分子运输屏障和脑组织稳态,如图1(A)所示。中枢神经系统的多种疾病和失调都与NVU的功能障碍有关,因此开发可概括NVU关键细胞及结构特征的体外病理药理模型的需求越来越大。近期,韩国科学技术研究院脑科学研究所的Seo等人构建了由人源永生化的六种不同类型细胞共培养组成的NVU模型。该模型采用生物兼容性好的胶原蛋白水凝胶作为细胞的三维基质,并在基质中引入可灌注通道以进行组织的内皮化和灌流培养,如图1(B)所示。该研究证明了多细胞三维共培养对血脑屏障功能成熟和对外源性刺激的炎症反应的调节有显著影响。
3D共培养NVU模型制造过程如图1(C)所示:首先,将星形胶质细胞、周细胞、神经元、小胶质细胞、少突胶质细胞和神经干细胞的细胞悬液与中性胶原溶液相混合,并注射到预先插入微针的矩形的PDMS腔中,在37℃孵育30分钟进行胶原凝胶化,然后将微针取出以在胶原凝胶中形成空心圆柱形管腔通道。接着,通过微通道输送含人脑微血管内皮细胞的悬液,并翻转芯片,使内皮细胞附着在胶原通道管腔表面。最后,通过内皮化通道注入培养基,进行多细胞NVU模型的长期培养。
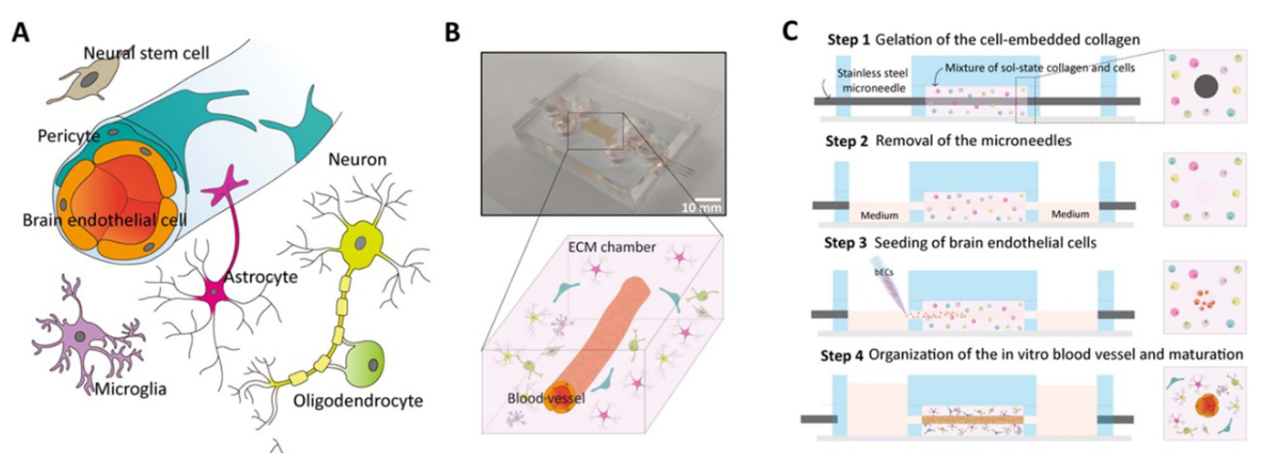
图1基于水凝胶的人体外神经血管单元芯片
通过该方法构建的各种细胞在整个培养期间(即1、3和5天)都保持高存活率(>90%),且表达了代表不同细胞类型的特异性蛋白标记物。从脑微血管到周围胶原空间的分子运输的时间演化结果表明,高密度周细胞播种会增强屏障功能。从培养第五天的NVU芯片上收集细胞培养基,并进行细胞因子分析,可以发现大量与血管发育成熟相关的细胞因子显著上调,表明在多细胞微环境中释放的可溶性因子具有旁分泌作用,对再现体内生理结构和功能至关重要。进一步通过血管通道灌流脂多糖(LPS)溶液诱导炎症反应,结果如图2所示,纯内皮细胞培养物中,LPS暴露增加了分子渗漏量,而在NVU模型中,血管通透性没有发生显著变化,且LPS刺激后NVU模型的血管、免疫反应、炎症反应相关细胞因子发生明显变化,调节炎症介质产生的布鲁顿酪氨酸激酶水平增加,这种上调代表了外部刺激下多细胞微环境中炎症防御系统的增强。

图2 炎症诱导条件下的NVU模型跨内皮渗透性
总之,该研究通过在三维胶原微环境中共培养6种NVU的重要组成细胞与可灌注的脑内皮细胞,制造了体外NVU仿生模型,验证了该模型多细胞介导的血脑屏障功能,未来可作为研究NVU构成细胞在生理和病理条件下功能的平台,以及评估中枢神经系统疾病(如多形性胶质母细胞瘤)药物疗效的体外模型。