







供稿人:贺佩 贺健康 供稿单位:机械制造系统工程国家重点实验室 发布日期:2020-12-15
心血管疾病仍然是全球范围内导致死亡的头号原因。在通过冠状动脉旁路移植术治疗心血管疾病中,尚无能够满足临床应用需求的小直径(<6 mm)组织工程血管(tissue engineered blood vessles,TEBV)。近年来,已有脱细胞基质、自组装细胞片、以及生物活性和仿生材料等多种组织工程血管的制备方法得到了广泛的发展并进行了临床应用研究,这些方法大多只能为支架提供机械支持,主要依赖于宿主组织的重塑过程,在帮助新生血管再生方面存在明显的局限性。目前为止,尚无一种能满足临床需要的小口径(<6 mm)组织工程化血管构建方法。为了解决这些问题,下一代TEBV不仅应该作为支架提供机械支持和促进宿主细胞的招募,而且还应该具有积极响应和耦合天然重塑过程的能力,以便在治疗后提供适应性治疗。
Shiyu Cheng等研究人员利用包埋液态金属的聚(L-丙交酯-co-ε-己内酯)(PLC)制成柔性可生物降解的电路,研制出一种能将柔性电子血管与三层血管细胞连接起来,具有良好的生物相容性、柔韧性、机械强度和降解性能的模拟和超越天然血管的电子血管。开发的电子血管能通过电刺激改善血管内皮化过程,并能使基因通过控制传递到血管的特定部位电穿孔电子血管在血管系统中具有良好的生物相容性,并在植入后3个月显示出良好的通畅性。电子血管将成为心血管系统诊断和治疗的理想平台,并通过创建血管-组织-机器接口的直接链接,极大地增强个性化医疗的能力。
作者通过聚四氟乙烯(PTFE)芯棒辅助,通过卷起基于PLC的MPC(MPC-PLC)膜(图1B)制造了电子血管(图1一),实现MPC(metal-polymer conductor,金属-聚合物导体)电路均匀分布在三维(3D)多层管状结构中,制造出了可生物降解的电子血管。
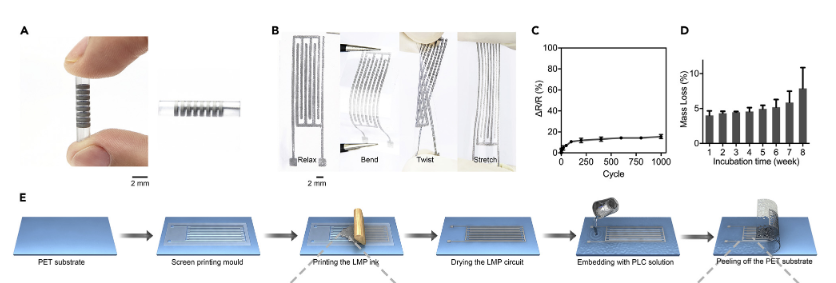
图一 电子血管的制造方法示意图 a电子血管实物图;b MPC-PLC膜的快照;c在1000个循环中,DR/R随180度的弯曲而变化(n=3);d MPC-PLC膜在8周孵育期间的质量损失(每个时间点n=3);e MPC-PLC膜的制作示意图
为了评价电子血管的生物相容性,作者利用利用多通道微流控芯片,将人脐静脉内皮细胞(HUVECs,蓝色)、人主动脉平滑肌细胞(SMCs,绿色)和人主动脉成纤维细胞(HAFs,红色)依次输送到MPC-PLC膜上,并分别均匀分布在血管的内层、中层和外层,通过微流控技术实现了多种细胞的在精确三维图形成像,结果表明设计的多层电子血管结构很好地模仿了天然血管的结构。同时随着时间的推移,Ca2+、Fe3+、Mg2+可以渗透到电子血管中,结果表明电子血管具有良好的血液生物相容性)。
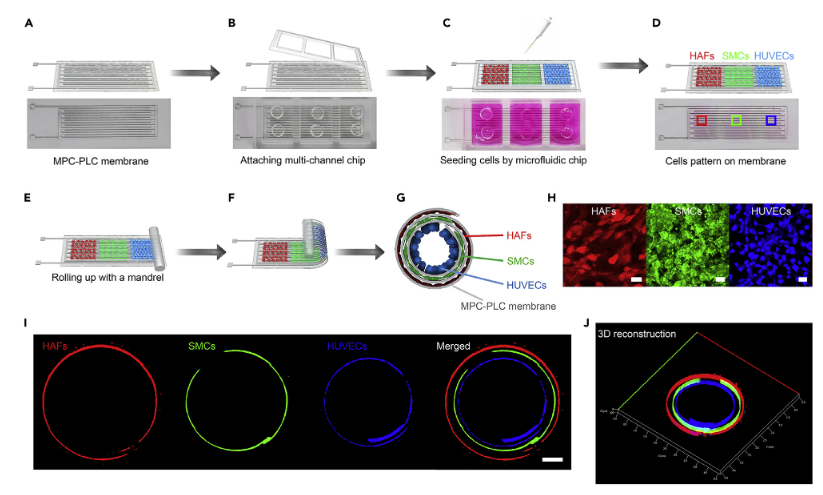
图二.电子血管的体外生物相容性a MPC-PLC膜; b将一个多通道微流控芯片附着在MPC-PLC膜上; c&d 使用聚二甲基硅氧烷微流控芯片将三种血管细胞(蓝色、HUVECs、绿色、SMC;红色、HAFs)图案化到MPC-PLC膜上;c 种植细胞;d细胞图案; e&f 用聚四氟乙烯芯棒将载细胞膜轧制成多层管状结构;g 不同细胞分布在不同层中的天然类血管结构的横断面图;h MPC-PLC膜上细胞的荧光图像;i 三种血管细胞分布在电子血管的不同层面; j 电子血管三维结构
为了探讨电子血管作为血管植入物的可行性,作者采用新西兰大白兔(200-300d,体重3-4 kg)作为动物模型,用电子血管代替了新西兰兔天然的颈动脉,通过普勒超声(图三)和冠状脉造影监测植入电子血管的情况。多普勒超声成像显示植入后3个月电子血管血流良好。同时血管的直径在植入后的半个月至3个月内保持在一个相对恒定的值,大约2.3毫米。作为血管通畅性的金标准,动脉造影显示电子血管与颈总动脉非常匹配,并允许良好的血流通过。

图三 电子血管原位监测a兔颈动脉电子血管示意图; b 颈动脉电子血管植入的端到端吻合方法;c 表示电子血管的两端; d&g在植入术后3个月多普勒超声显像对电子血管的实时监测;手术部位的实时血流和同步的超声脉冲。
本文中,作者通过将液态金属基导电电路与生物可降解聚合物相结合,开发出一种具有优良生物相容性、柔韧性、导电性、机械强度和可降解性的电子血管,它能使电刺激促进内皮化过程,并通过电迁移将基因传递到血管细胞的特定层。在兔血管系统植入3个月后,它具有良好的通畅性和生物安全性。未来,电子血管可以与其他电子元件和设备集成,实现诊断和治疗功能,并通过在血管-组织-机器接口中创建一个直接链接,能够极大增强个性化医疗能力。